来源:中考网整合 2010-10-06 10:20:06
中考化学复习教案:氧气要点精讲
2.氧气
(1)氧气的工业制法一一分离液态空气法

③实验装置:(发生装置、收集装置)
发生装置的选择依据:反应物的状态及反应条件。
收集装置的选择依据:气体的水溶性、气体的密度。具体装置从略。④操作步骤:a.检查装置的气密性;b.将药品装入试管(或锥形瓶或广口瓶)中;c.从长颈漏斗或分液漏斗中加入过氧化氢溶液;d.收集氧气。
⑤收集方法:a.排水法;向上排空气法。
⑥检验方法:将带火星的木条伸入集气瓶中,若木条立即复燃,证明是氧气。
⑦验满方法:a.用排水法集气时,如果集气瓶口有大气泡冒出,证明瓶中没有水,即已集满。b.用向上排空气法时,用带火星的木条放在集气瓶口(注意:不能伸入瓶内),若木条复燃,证明集满。
(3)氧气的性质
氧气是一种化学性质比较活泼的气体。它在氧化反应中提供氧,具有氧化性,是一种常用的氧化剂。
|
反应物 |
反应物 |
在空气中燃烧 |
在氧气中燃烧 |
化学方程式 |
|
木炭(主要成分是碳) |
黑色 固体 |
木炭红热、无烟、无焰、生成无色无味的气体 |
剧烈燃烧,发白光、放热,生成无色无味可使澄清石灰水变浑浊的气体 |
C+O2CO2 |
|
硫磺(硫) |
黄色粉末 |
微弱的淡蓝色火焰、无烟、生成有刺激性气味的气体 |
剧烈燃烧,发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体 |
S+O2SO2 |
|
红磷 |
暗红色固体 |
黄色火焰,放热有大量白烟产生 |
剧烈燃烧,耀眼白光,放热,生成大量白烟 |
4P+5O22P2O5 |
|
铁 |
银白色固体 |
持续加热发红,离火后变冷 |
用火柴引燃细铁丝,剧烈燃烧,放热,火星四射,生成黑色固体 |
3Fe+2O2Fe3O4 |
|
石蜡 |
白色固体 |
黄白色光,明亮火焰,放热,稍有黑烟 |
剧烈燃烧,发白光,放热 |
|

答案:白磷燃烧,容器内产生大量白烟;"4";动能转化为化学能,白磷的着火点比较低,空气中氧气的体积占五分之一。
【例2】某班级的探究小组在学习了催化剂的知识后,他们想研究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和后续操作:
①任取两份氯酸钾,分别放入两支相同的试管,在其中一份中加入经精确称量的ng氧化铜粉末。
②将两份氯酸钾同时在相同的条件下正确加热,将放出的气体通入水中,观察放出气体的快慢。
③停止加热、冷却,将原先混有氧化铜的反应后的混合物加水溶解,小心过滤,得滤出物,洗涤并干燥。
④观察滤出物的状态和颜色。
⑤将滤出物和炭粉混合,在密闭容器中高温加热,将反应产生的气体通入澄清石灰水中,并观察实验现象。
(1)以上实验步骤,有一步不够严密,请指出是哪一步?______________
(2)要达到实验目的,除改进不严密的实验步骤外,还必须增加一个实验步骤,这个实验步骤是______________________________________________。
(3)若用另一个实验装置和操作替换第⑤步实验,也可以达到实验目的,请把图中仪器连接成一个符合实验目的的实验装置,这个实验装置的接口连接顺序是____接____;____接_____;______接_______。(气流的方向从左往右)
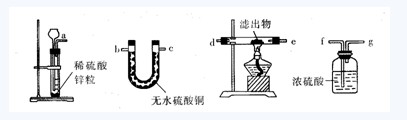
【解析】对比实验是一项科研活动,要求控制变量,氧气产生的多少、快慢与很多量有关,如氯酸钾的质量、温度、是否有催化剂、加热的时间等。控制变量就是保证两份氯酸钾的质量相等,相同的温度,同时加热,只有一个量是可变的,那就是有无CuO。实验的目的是研究CuO在氯酸钾反应中的作用。所以第①步任取两份氯酸钾进行加热,人为地增加了变量,当出现不同的效果后,很难找到与结果相关的变量,这是不科学的。
因为是研究CuO的催化作用,除了认真观察反应速率外,还要研究CuO在化学反应前后质量及化学性质是否改变。研究质量的变化,必须在反应结束后要精确称量滤出物质量;研究CuO化学性质的变化,必须通过实验⑤或(3)来验证。
答案:(1)第①步;(2)精确称量滤出物质量;(3)afgd(或e)e(或d)b(或c)
欢迎使用手机、平板等移动设备访问中考网,2025中考一路陪伴同行!>>点击查看