来源:网络资源 2022-10-16 12:07:44
分解过氧化氢溶液制取氧气
(1)药品:过氧化氢溶液是无色液体,二氧化锰是黑色粉末。
(2)反应原理:
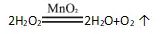
(3)发生装置:由于反应物是固体和液体,反应不需要加热,所以选择固液混合在常温下制取气体的装置。

(4)实验步骤
①检查装置的气密性。
②向锥形瓶中加入二氧化锰固体。
③塞好带有长颈漏斗(或分液漏斗)和导管的双孔塞。
④向长颈漏斗(或分液漏斗)中加入过氧化氢溶液。
⑤用排水集气法收集。
收集、检验、验满同上
注意:
a.用过氧化氢溶液制氧气的发生装置中使用长颈漏斗便于加入液体药品;使用分液漏斗便于控制滴液速率。
b.使用带有长颈漏斗的发生装置时,要注意长颈漏斗下端管口应伸到液面以下,以防止产生的气体从长颈漏斗口逸出。
c不能用加热过氧化氢溶液的方法制取氧气!因为加热过氧化氢溶液时,过氧化氢分解产生的氧气和水蒸气一起逸出,水蒸气的干扰会使带火星的木条不能复燃。
3.催化剂
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生变化的物质叫做催化剂。催化剂在化学反应中所起的作用叫催化作用。
催化剂只能改变化学反应的速率,不能改变化学反应的产率。
催化剂在化学反应前后不改变,其反应过程中有可能改变。
不同的化学反应有不同的催化剂,同一化学反应也可能有几种催化剂。
生物体内的酶属于催化剂。
催化剂的特点可以概括为“一变二不变”,一变是能够改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变。
欢迎使用手机、平板等移动设备访问中考网,2023中考一路陪伴同行!>>点击查看