来源:网络资源 2022-11-02 13:04:41
钠及其化合物
一、钠的物理性质
1.颜色:银白色、有金属光泽。
2.密度:钠、水和煤油的密度大小为ρ(水)>ρ(钠)>ρ(煤油)。
3.熔点:小于(填“大于”“小于”或“等于”)100 ℃。
4.硬度:质地较软。
二、从原子结构认识钠的化学性质——还原性

1.钠与非金属单质反应
(1)与O2反应
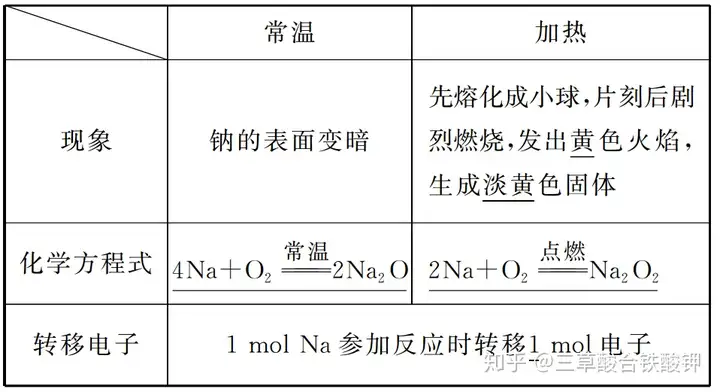
(2)与Cl2反应的化学方程式:2Na+Cl2点燃(=====)2NaCl。
(3)与S反应的化学方程式:2Na+S△(=====)Na2S。
2.钠与水、盐溶液的反应
(1)钠与水的反应
①钠与水反应的离子方程式:2Na+2H2O===2Na++2OH-+H2↑。
②钠与水(含酚酞)反应的实验现象及解释:

(2)钠与盐溶液的反应
Na先和水反应生成NaOH再与盐溶液反应,并判断是否发生复分解反应
如钠投入CuSO4溶液中,反应的离子方程式为2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑。
钠投入BaCl2溶液中,反应的化学方程式为2Na+2H2O===2NaOH+H2↑。
3.钠与盐酸的反应
钠与盐酸反应的离子方程式为2Na+2H+===2Na++H2↑
三、钠的制取、保存及用途
1.制取:化学方程式为2NaCl(熔融)通电(=====)2Na+Cl2↑。
2.保存:密封保存,通常保存在石蜡油或煤油中。
3.用途
(1)钠、钾合金(液态)可用于原子反应堆的导热剂。
(2)作强还原剂,将某些稀有金属从它们的卤化物中还原出来,如4Na+TiCl4熔融(=====)Ti+4NaCl。
(3)用作电光源,制作高压钠灯。
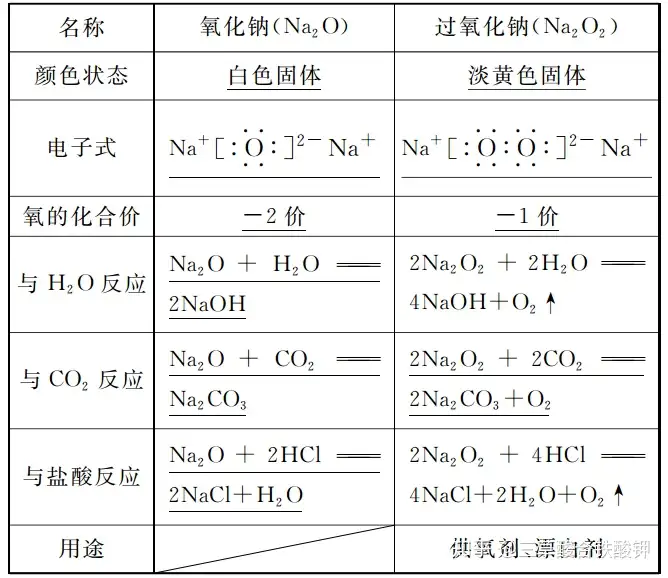
四、氧化钠与过氧化钠的比较
总结
1.钠的取用方法:用镊子夹取一小块钠,用滤纸吸干表面的煤油,用小刀切取黄豆大小的钠,剩余的钠放回试剂瓶。
2.钠失火的处理:沙土盖灭,不能用水或泡沫灭火器灭火。
3.Na2O2中氧元素的化合价为-1价而不是-2价。
4.Na2O2晶体中阴、阳离子个数比为1∶2而不是1∶1。
5.过氧化钠与还原性溶液反应的化学方程式的书写步骤:
第一步:Na2O2与溶液中的水反应生成NaOH和O2;
第二步:反应生成的O2与还原性盐发生氧化还原反应;
第三步:将上述两个反应的化学方程式合并,即得总的化学方程式。
6.Na2O2与H2O、CO2反应的两个常见误区
(1)Na2O2与H2O、CO2反应都是自身的氧化还原反应;
(2)1 mol Na2O2与足量CO2或H2O发生反应时,转移的电子数是NA而不是2NA。
1.金属钠与盐或碱溶液反应的思维模板

2.金属钠与溶液反应现象分析思维模板
(1)共性:因为钠与不同的水溶液反应均属于剧烈的置换反应,故有共同的现象产生:①浮:钠浮在液面上;②熔:钠熔化成光亮的小球;③游:在液面上不停地游动直至反应完;④响:反应中不停地发出“嘶嘶”的响声。
(2)差异性:与酸、强酸弱碱盐溶液反应时,由于溶液中H+浓度较大,反应比与水还要剧烈,最后钠可能在液面上燃烧;与盐溶液反应时,还可能会生成沉淀(如生成难溶碱)、气体(NH3)等。
1.钠与氧气反应的产物与反应温度有关,加热或点燃产物是过氧化钠。
2.不管生成氧化钠还是过氧化钠,金属钠失电子均变为+1价的阳离子,因而等量的钠完全反应失去的电子数相同
1.有关Na2O2与CO2、H2O的反应的几个重要关系
2CO2+2Na2O2===2Na2CO3+O2
2H2O+2Na2O2===4NaOH+O2↑
(1)物质的量的关系
无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
(2)气体体积关系
若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量等于原混合气体体积的2(1)且等于生成氧气的体积。
(3)电子转移关系
当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e-。
(4)固体质量关系
相当于固体(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作发生相应的反应:Na2O2+CO===Na2CO3、Na2O2+H2===2NaOH(实际上两反应不能发生)。
(5)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O(g)发生反应。
2.增重量等于可燃物质量的规律
凡分子组成符合(CO)m·(H2)n的物质,Wg该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量的Na2O2后,固体增重必为Wg。或是由C、H、O三种元素组成的物质,只要C、O原子个数比为1∶1,即可满足该条件。
中学阶段常见的符合这一关系的物质有:
(1)无机物:H2、CO及H2和CO的混合气体。
(2)有机物:CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、C6H12O6(葡萄糖)等。
过氧化钠的强氧化性
1.Na2O2与SO2反应:Na2O2+SO2===Na2SO4。
2.Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+,同时生成Fe(OH)3沉淀。
3.Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊。
4.Na2O2投入Na2SO3溶液中,可将SO3(2-)氧化成SO4(2-)。
5.Na2O2具有漂白性,投入品红溶液中,可使品红溶液褪色
钠的重要化合物
1.碳酸钠和碳酸氢钠

2.钠及其重要化合物间的转化关系

图中带标号的有关反应的化学方程式:
①2Na+O2点燃Na2O2;
②2Na+2H2O===2NaOH+H2↑;
③2Na2O2+2H2O===4NaOH+O2↑;
④2Na2O2+2CO2===2Na2CO3+O2;
⑤2NaOH+CO2===Na2CO3+H2O;
⑥2NaCl+2H2O电解2NaOH+Cl2↑+H2↑。
3.Na2CO3的制备及用途
(1)Na2CO3的工业制备——侯氏制碱法
①制备原理
把二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出,过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠。
②反应的化学方程式
a.NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;
b.2NaHCO3△(=====)Na2CO3+CO2↑+H2O。
(2)Na2CO3、NaHCO3的用途
①Na2CO3是一种非常重要的化工原料,在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业中有着广泛的应用。
②NaHCO3是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过多的一种药剂。
4.Na2CO3和NaHCO3的比较
(1)Na2CO3、NaHCO3的鉴别
①若为固体
可利用加热法。加热产生使澄清石灰水变浑浊的气体的是NaHCO3。
②若为溶液
可利用沉淀法。加入BaCl2溶液,产生白色沉淀的是Na2CO3;也可利用气体法。滴加稀盐酸,立即产生气泡的是NaHCO3,开始无气泡产生的是Na2CO3。
(2)Na2CO3、NaHCO3和盐酸的反应
Na2CO3溶液和稀盐酸反应可理解为分步反应:
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3溶液和稀盐酸反应的化学方程式为
NaHCO3+HCl===NaCl+CO2↑+H2O
①放出CO2的速率
NaHCO3溶液与盐酸反应放出CO2的速率快。
②Na2CO3溶液与盐酸的互滴鉴别
向Na2CO3溶液中逐滴加入盐酸,开始无气泡产生,而向盐酸中滴加Na2CO3溶液,开始就有气泡产生。
③CO2生成量比较
a.等物质的量的Na2CO3、NaHCO3分别与足量的盐酸反应,产生的CO2相等。
b.等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多。
c.等量的盐酸与足量的Na2CO3、NaHCO3分别反应,NaHCO3产生的CO2多。
d.一定量的NaHCO3受热分解产生的CO2量与受热分解后的残留物与盐酸反应产生的CO2量相等。
5.数形结合思想理解Na2CO3、NaHCO3与盐酸的反应
(1)盐酸逐滴加入Na2CO3溶液中(盐酸不足时)
①现象:开始无明显现象,后有无色气体放出。
②反应:无明显现象时反应的离子方程式:CO3(2-)+H+===HCO3(-),有无色气体放出时反应的离子方程式:HCO3(-)+H+===CO2↑+H2O。
(2)Na2CO3溶液逐滴加入稀盐酸中(盐酸过量时)
①现象:有无色气体放出。鉴别Na2CO3、NaHCO3的常用方法
②反应的离子方程式:CO3(2-)+2H+===CO2↑+H2O。
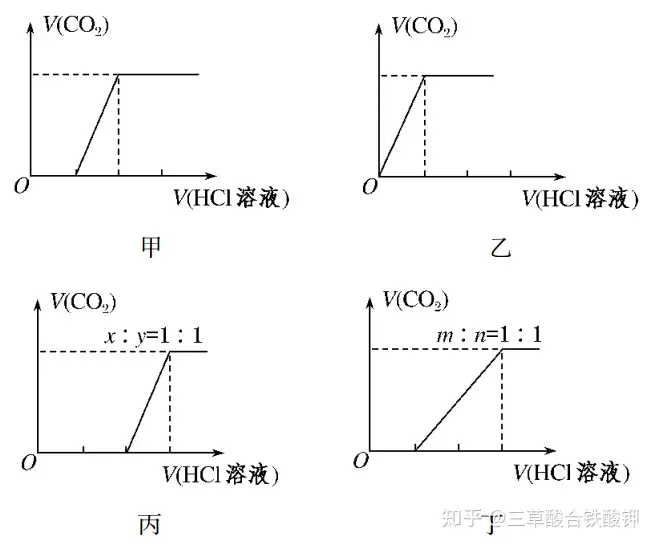
(3)碳酸钠、碳酸氢钠与盐酸反应的基本图象
①向Na2CO3中逐滴加入盐酸,消耗HCl溶液的体积与产生CO2的体积的关系如图甲所示。
②向NaHCO3中逐滴加入盐酸,消耗HCl溶液的体积与产生CO2的体积的关系如图乙所示。
③向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl溶液的体积与产生CO2的体积的关系如图丙所示(设NaOH、Na2CO3的物质的量之比为x∶y=1∶1,其他比例时的图象略)。
④向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl溶液的体积与产生CO2的体积的关系如图丁所示(设Na2CO3、NaHCO3的物质的量之比为m∶n=1∶1,其他比例时的图象略)。
鉴别Na2CO3、NaHCO3的常用方法

欢迎使用手机、平板等移动设备访问中考网,2023中考一路陪伴同行!>>点击查看