来源:网络资源 2022-12-10 20:33:25
现阶段,很多学生已经进入初三化学下册的学习,或者是在即将来临的寒假期间准备预习,这时候都将接触到中考化学中所占分值最多的酸碱盐。其中,复分解反应,作为四大基本化学反应之一,无疑是中考的重点及难点。而常见酸碱盐的溶解性则是判断复分解反应能否发生的重要依据。
如果你是中考生,这张常见酸碱盐溶解性表,除了背下来,你别无选择。
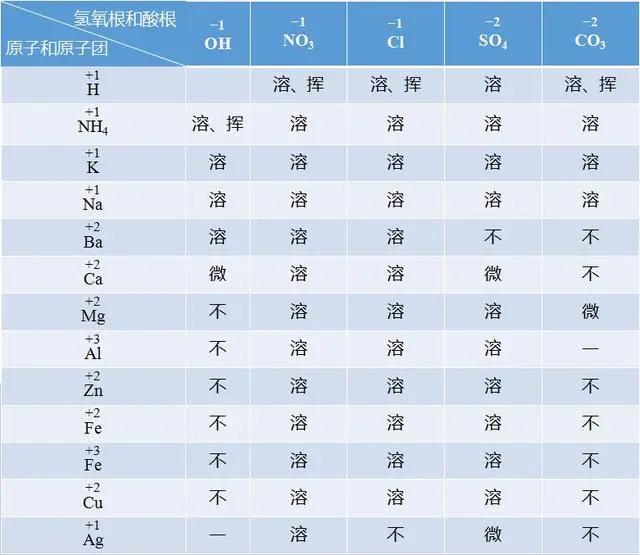
1.酸:氢离子和各酸根离子构成酸,都是可溶的。
注意:硝酸(HNO3),盐酸(HCl)以及硫酸(H2SO4)属于三大强酸,碳酸(H2CO3)则属于弱酸。除了浓硫酸具有吸水性,另外三种酸都具有挥发性。
2.碱:由金属元素或铵根与氢氧根组成的化合物,称为碱。记住常见的碱中可溶性的碱,五个字:“钾钠钙钡铵”【KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3∙H2O】都是可溶性的碱。
补充:氢氧化钙微溶于水,也就是我们经常提到的澄清石灰水,氢氧化铜是蓝色絮状沉淀,氢氧化铁是红棕色的絮状沉淀。物质的特性,在推断题中常作为物质的信息点和突破口。

Cu(OH)2沉淀

Fe(OH)3沉淀
前方高能!重!点!来!了!
3.盐:金属离子(或铵根)与酸根离子构成的化合物
3.1.三个字——“钾钠铵”。
在盐的分类中,根据盐中金属元素(或铵根) 的种类,盐可以分为钾盐(KCl、K2CO3、K2SO4),钠盐(NaCl、Na2CO3、NaNO3),铵盐(NH4Cl、NH4NO3、NH4HCO3)等。
由钾、钠、铵【K、Na、NH4】组成的盐,一定都是可溶的,以上已举例。
3.2.三个字——“三强酸”
找三强酸的酸根,前面讲到三大强酸,分别是硝酸,盐酸,和硫酸。当盐中有盐酸根(Cl−),硫酸根(SO42−),硝酸根(NO3−)的时候,都是可溶的。比如:NaCl、Na2SO4、NaNO3。
但是!但是!记住两个挑事儿的特例
①含有盐酸根(Cl−)的盐当中,氯化银(AgCl)是不可溶的白色沉淀;
②含有硫酸根(SO42−)的盐中,硫酸钡(BaSO4)是不可溶的白色沉淀;
这两个是含有三强酸酸根的常见盐当中唯一两个不可溶的碱。
所以,如果某种盐中既没有钾钠铵,也没有三强酸酸根,则该种盐为不可溶性盐。你也会发现,大部分的碳酸盐,都是不可溶的。
下面你可以花30s时间来记住以上几点。
然后检查一下自己是否有理解和记住:判断以下三种物质的溶解性:
(1) MgSO4 (2) BaCO3 (3) Mg(OH)2
(1) MgSO4:属于盐,以三强酸中的硫酸根结尾,为可溶性盐;
(2) BaCO3:属于盐,没有钾钠铵,也没有三强酸的酸根,为不可溶性盐;
(3) Mg(OH)2:属于碱,非“钾钠钙钡铵”其中之一,为不可溶性碱。
欢迎使用手机、平板等移动设备访问中考网,2025中考一路陪伴同行!>>点击查看