来源:网络资源 2023-01-07 17:42:06
![]()
1、原子结构示意图的认识
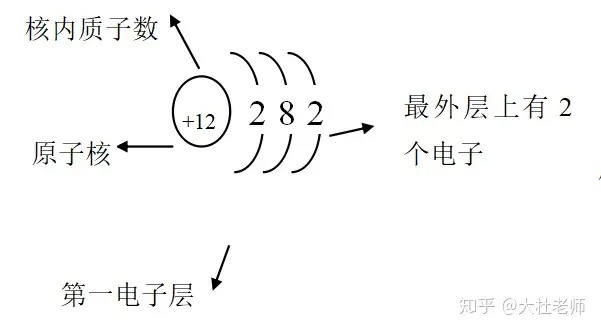
2、在原子中核电荷数=质子数=核外电子数
3、原子的质量主要集中在原子核上
4、相对原子质量≈质子数+中子数
5、决定元素种类:质子数(核电荷数)
决定元素化学性质:最外层电子数
决定原子的质量:原子核
6、说明
(1)最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)
(2)最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
![]()
1、定义:具有相同核电荷数(质子数)的一类原子的总称
注意:
*一种元素与另一种元素的本质区别:质子数不同
*由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
2、表示方法——元素符号——拉丁文名称的第一个字母大写
(1)意义:表示某种元素,或者该种元素的一个原子
如:O既表示氧元素又表示氧原子。
(2)有些元素符号还可表示一种单质 如Fe、He 、C 、Si
(3)在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3个氧原子
3、元素周期表
(1)发现者:门捷列夫
(2)排列依据

(3)原子序数=质子数
4、分类
化学元素是根据原子核电荷的多少对原子进行分类的一种方法,把核电荷数相同的一类原子称为一种元素。一般少于4个,为金属元素。
一般多于或等于4个,为非金属元素。
等于8个(氦为2个)为稀有气体元素。
5、其他
元素之最:地壳:O、Si、Al、Fe
细胞:O、C、H
![]()
1、定义:带电的原子或原子团
2、表示方法及意义:如Fe3+ :一个铁离子带3个单位正电荷
3、离子结构示意图的认识
注意:
与原子示意图的区别:质子数=电子数则为原子结构示意图,原子数≠电子数为离子结构示意图
质子数>电子数:则为阳离子,如Al3+
质子数<电子数:则为阴离子,O2-
4、同种元素的原子与离子比较:
①质子数相等
②电子数及最外层电子数不同,
③电子层数可能相同
5、与原子的区别与联系

1、化合价
(1)写法及意义
Mg:镁元素化合价为+2价
MgCl2:氯化镁中镁元素化合价为+2价
(2)几种数字的含义
Fe2+ 每个亚铁离子带两个单位正电荷
3 Fe2+:3个亚铁离子
2H2O 两个水分子, 每个水分子含有2个氢原子
(3)化合物中各元素正、负化合价的代数和为零
(4)化合价是元素的原子在形成化合物时表现出来的性质,所以单质分子中元素化合价为0
2、化学式
(1)写法:
a、单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气、氯气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2、Cl2 。
b、化合物:正价在前,负价在后(NH3,CH4除外)
(2)计算:
a、计算相对分子质量=各元素的相对原子质量×原子个数之和
b、计算物质组成元素的质量比:相对原子质量×原子个数之比
c、计算物质中某元素的质量分数:物质中某元素的质量/物质的质量 ×100%
欢迎使用手机、平板等移动设备访问中考网,2024中考一路陪伴同行!>>点击查看