来源:网络资源 2023-01-07 17:53:17
原子的构成
⒈构成原子的粒子

⒉在原子里,核电荷数=质子数=核外电子数,原子不显电性。
考点2 相对原子质量
⒈相对原子质量的标准:碳-12原子质量的1/12。
⒉表达式:Ar=其他原子的质量/(碳-12的质量×1/12)
相对原子质量是一个比值,不是原子的实际质量。
⒊原子的质量主要集中在原子核上,相对原子质量≈质子数+中子数
考点3 元素
⒈元素的定义:具有相同核电荷数(即核内质子数)的一类原子的总称。
⒉元素的种类决定于核电荷数(即核内质子数)。
⒊地壳中含量列前四位的元素(质量分数):氧、硅、铝、铁,其中含量最多的元素(非金属元素)是氧,含量最多的金属元素是铝。
⒋生物细胞中含量列前四位的元素:氧、碳、氢、氮。
考点4 元素符号
⒈元素符号:用元素的拉丁文名称的第一个大写字母来元素。
⒉书写:
⑴由一个字母表示的元素符号要大写,如:H、O、S、C、P等。
⑵由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”),如:Ca、Na、Mg、Zn等。
⒊元素符号表示的意义:⑴表示一种元素;⑵表示这种元素的一个原子。例如:
H:①表示氢元素
②表示一个氢原子
2H:表示二个氢原子,2H不能说成二个氢元素
注意:元素只讲种类,不讲个数;原子即讲种类,又讲个数。
考点5 物质组成、构成的描述
⒈物质由元素组成:如水是由氢元素和氧元素组成的。
⒉物质由粒子(分子、原子、离子)构成。例如:
⑴水是由水分子构成的。
⑵金是由金原子构成的。
⑶氯化钠是由钠离子和氯离子构成的。
⒊分子是由原子构成的。
如:水分子是由氢原子和氧原子构成的;每个水分子是由二个氢原子和一个氧原子构成的。
考点6 元素周期表简介
⒈元素周期表

⑴周期表每一横行叫做一个周期,共有7个周期。
⑵周期表每一个纵行叫做一族,共有16个族(8、9、10三个纵行共同组成一个族)。
⒉元素周期表的意义
⑴是学习和研究化学知识的重要工具;
⑵为寻找新元素提供了理论依据;
⑶由于在元素周期表中位置越靠近的元素,性质越相似,可以启发人们在元素周期表的一定区域寻找新物质(如农药、催化剂、半导体材料等)。
考点7 核外电子的分层排布
⒈电子排布——分层排布:第一层不超过2个;第二层不超过8个;……最外层不超过8个。
⒉原子结构示意图:
⑴含义:(以镁原子结构示意图为例)
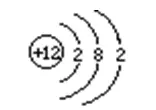
⑵原子的最外层电子数与元素的分类、化学性质的关系

①元素的化学性质决定于原子的最外层电子数。
②原子最外层电子数为8(氦为2)的结构称为稳定结构。
⑶原子、阳离子、阴离子的判断
① 原子:质子数=核外电子数
② 阴离子:质子数<核外电子数
③ 阳离子:质子数>核外电子数
考点8 离子
⒈定义:带电荷的原子(或原子团)。
⒉分类(注:本文中加减均为上标)
阳离子:带正电荷的离子,如Na+、Mg2+
阴离子:带负电荷的离子,如Cl-、O2-
⒊离子符号表示的意义:表示离子(或一个离子),如:Mg2+——表示镁离子(一个镁离子)
2Mg2+ ——第一个2表示两个镁离子
第二个2表示每个镁离子带两个单位的正电荷
⑴离子符号前面的化学计量数(系数)表示离子的个数;
⑵离子符号的表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。离子带1个单位的正电荷或个单位的负电荷,“1”省略不写。如: 阳离子:Na+、Ca2+、Al3+等,阴离子:Cl-、S2‑等
⒋有关离子的小结
⑴金属离子带正电荷,非金属离子带负电荷;
⑵离子所带的电荷=该元素的化合价
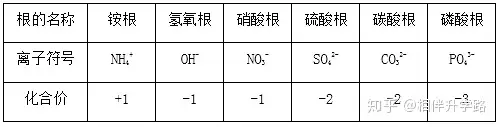
⑶常见原子团离子(请注意上下标)
SO42- 硫酸根离子 CO32- 碳酸根离子
NO3- 硝酸根离子 OH- 氢氧根离子
NH4+ 铵根离子
考点9 化学式
⒈化学式的写法
A.单质的化学式
⑴双原子分子的化学式,如:氢气——H2,氧气——O2,氮气——N2,氯气——Cl2。
⑵稀有气体、金属与固体非金属单质:由原子构成,它们的化学式用元素符号来表示。
B.化合物的化学式
正价写左边,负价写右边,同时正、负化合价的代数和为零。
⒉几点注意事项
⑴一种物质只有一个化学式,书写化学式时,要考虑到元素的排列顺序,还要考虑到表示原子个数的角码应写的部位。
⑵一般化合物的中文名称,其顺序和化学式书写的顺序正好相反。
⒊化学式的涵义(以CO2为例说明)
⑴宏观上
表示一种物质:表示二氧化碳。
表示该物质由哪些元素组成:表示二氧化碳由碳元素和氧元素组成。
⑵微观上
表示该物质的一个分子:表示一个二氧化碳分子。
表示分子的构成:表示每个二氧化碳分子由一个碳原子和二个氧原子构成。
考点10 化合价
⒈元素化合价的表示方法
化合价用+1、+2、+3、-1、-2……表示,标在元素符号的正上方,如:Na、 Cl、 Mg、 O。要注意化合价的表示方法与离子符号的区别,离子所带电荷符号用+、2+、-、2-……表示,标在元素符号的右上角,如:
![]()
⒉元素化合价的一般规律
⑴氢元素的化合价通常显+1价,氧元素的化合价显-2价。
⑵在化合物中,金属元素为正价。
⑶非金属与氢或金属化合时,非金属元素显负价;非金属与氧元素化合时,非金属元素显正价。
⑷在化合物中,正、负化合价的代数和为零。
⑸在单质中元素的化合价为零。
⒊牢记常见元素的化合价
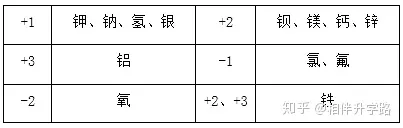
⒋常见根(原子团)的化合价
常见元素的化合价(正价):
一价钾钠氢与银,二价钙镁钡与锌,三价金属元素铝;
一五七变价氯,二四五氮,硫四六,三五有磷,二四碳;
一二铜,二三铁,二四六七锰特别。
⒌化合价的应用
⑴检验化学式的正误;
⑵根据化学式判断元素的化合价;
⑶根据元素的化合价推求实际存在物质的化学式。
考点11 有关化学式的计算
⒈计算物质的相对分子质量=各元素的相对原子质量×原子个数之和
⒉计算物质组成元素的质量比=各元素的相对原子质量×原子个数之比
⒊计算物质中某元素的质量分数
物质中某元素的质量分数=(该元素的相对原子质量×原子个数)÷化合物的相对分子质量×100%
⒋计算一定质量的化合物中含某元素的质量
某元素的质量=化合物的质量×化合物中该元素的质量分数
变形:化合物的质量=某元素的质量÷化合物中该元素的质量分数
⒌已知化合物中各元素的质量比和各元素的相对原子质量,求原子个数比
各元素的原子个数比=各元素的质量/各元素的相对原子质量之比
检测题
一、选择题(本题共10小题,每小题只有一个选项符合题意。每小题2分,共20分)
1.在地震后的救援行动中,为了搜索埋在废墟中的幸存者,人们用了搜救犬,搜救犬能根据人体发出的气味发现幸存者。试用化学观点从微粒的角度分析能发现幸存者的原因是( )
A.分子在不断运动 B.分子间有间隔
C.分子的体积很小 D.分子的质量很小
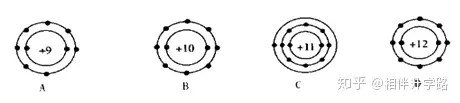
2.下列选项中代表离子的是(说明:数字代表质子数,“+”表示原子核所带的电荷,黑点代表核外电子) ( )
3.分子和原子的根本区别是( )
A.分子比原子大
B.分子可分,原子不可分
C.在化学变化中,分子可以再分,原子不能再分
D.分子可以构成物质,原子不能构成物质
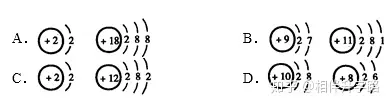
4.下列各组原子结构示意图中,所表示的两种元素具有相似化学性质的是 ( )
5.能证明分子在化学反应中可以再分的事实是( )
A.氧化汞 受热分解 B.用自来水制蒸馏水
C.分离空气法制氧气 D.碘升华为碘蒸气
6.下列操作能将物质完全分散成 分子的是BC未学到 ( )
A.在研钵里用杵研磨粒状胆矾 B.将蔗糖溶于水
C.把植物油滴入水中用力振荡 D.加热高锰酸钾
7.A、B、C三只小烧杯内依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按图所示进行探究活动,不能得到的结论是( )
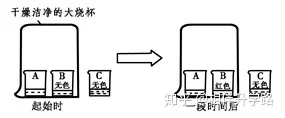
A. 氨分子是不断运动的
B. 碱能使酚酞溶液变红
C. 空气不能使酚酞溶液变红
D.氨分子溶于水,形成氨水使酚酞溶液变红
8.下列对生产、生活现象的解释正确的是( )
A.铝锭难被压缩,因为铝原子间没有间隙
B.温度计里的汞柱下降,因为原子随温度的降低而变小
C.石油气加压后贮存在钢瓶中,因为气体分子体积很小
D.氧气和液氧都可以助燃,因为相同物质的分子,其化学性质相同
9.某些花岗岩石材中含有放射性元素氡,一种氡原子的质子数为86,中子数为136,这种氡原子的核外电子数为( )
A.50 B.86
C.136 D.222
10.元素周期表是学习化学的重要工具。右图是元素周期表中的一格,从中获取的信息错误的是( )
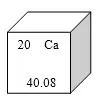
A.该元素的原子序数为20
B.该元素属于非金属元素
C.该元素的原子核外有20个电子
D.该元素的相对原子质量为40.08
二、选择题(本题共5小题,每小题有一个或两个选项符合题意。错选、多选不给分。有两个答案的,只选一个且正确,给2分。每小题3分,共15分)
11.十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出了分子的概念,他认为:①一切物质都是由分子构成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的最小粒子;⑤分子的质量等于组成它的原子的质量之和;⑥分子在不停地运动。从你所学的知识看,上述观点存在明显不足的是 ( )
A.①③ B.①②⑤
C.④⑤⑥ D.③⑤
12.下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A.它们的质子数不同
B.它们的最外层电子数相同
C.它们的核外电子数不同
D.它们属于同一种元素
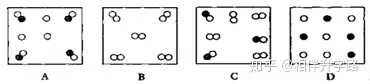
13.下图是气体物质的粒子示意图,图中“ ”和“ ”分别表示两种不同的原子,其中表示纯净物的是( )
14.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如用 C表示核内有6个质子和7个中子的碳原子。则 Cl和 Cl( )
A.原子核内质子数目不同
B.属于同种元素
C.原子中核外电子数相同
D.原子核内中子数目相同
15.两位美国科学家彼得·阿格雷和罗得里克·麦金农,因为发现细胞膜水通道,以及对离子通道结构和机理研究作出的开创性贡献而获得2003年诺贝尔化学奖。他们之所以获得诺贝尔化学奖而不是生理学或医学奖是( )
A.他们的研究和化学物质水有关
B.他们的研究有利于研制针对一些 神经系统疾病和心血管疾病的药
C.他们的研究深入到分子、原子的层次
D.他们的研究深入到细胞的层次
三、填空题(本题包括10小题。(17、21、25每空2分,其余每空1分,共65分)
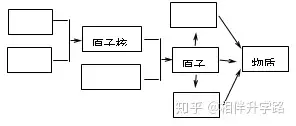
16.(5分)通过学习我们对“物质构成的奥秘 ”已有一定的了解。请在右图方框中填写粒子名称,表示各种粒子是怎样构成物质的。
17.(6分)用分子原子的观点解释下列现象:
(1)湿衣服晾在太阳晒着的地方更容易干。
(2)1L酒精和1L水混合,总体积小于2L。
(3)温度计里的水银受热体积膨胀。
18.(8分)按要求写出下列物质的化学式(各写2个):
(1)由分子构成的物质 _____;
(2)由原子直接构成的物质_____;
(3)由离子构成的物质______ ;
(4)同种元素组成的不同物质_____;
19.(6分)在①分子、②原子、③质子、④中子、⑤电子、⑥离子这些微粒中:
(1)能构成物质的微粒有__________;
(2)显电中性的微粒有______ ______;
(3)质量最小的微粒是____________;
(4)一定带正电荷的微粒有____ ______;
(5)一定带负电的微粒有__________;
(6)可能带正电也可能带负电的是_____ 。
20.(10分)右图是某粒子的结构示意图,回答下列问题:
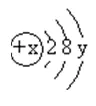
(1)x表示_____,它决定元素的_____,y表示_____ ,它决定元素的_____,该元素位于元素周期表第_____周期。
(2)当x=12时,y=_____,该粒子为原子。
(3)当x=17时,该粒子带1个单位负电荷,则y=___。
(4)当y=1时,该粒子易_______电子,变成带_____电荷的_________。
21.(6分)右图为氧化汞受热分解的微观过程示意图。
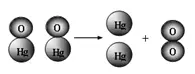
从图示中能总结出哪些规律(至少写3条):
(1)_________________。
(2)_________________。
(3)_________________。
22.(5分)2011年3月11日下午,日本宫城县发生里氏9.0级大地震,引发的海啸导致福岛核电站发生重大核事故。
(1)核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生钡、氙、碘、铯、锶等原子和一些粒子及射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电。
①从物质的变化上看,核变化与化学变化的相同点是 _____;从原子的变化上看,核变化与化学变化的不同点是_____。
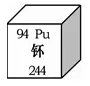
②右图为元素周期表中钚元素的相关信息,下列说法正确的是_____。
A.钚是金属元素 B.钚原子核外有94个电子
C.钚元素的中子数94 D.钚的相对原子质量为244g
(2)针对日本核泄漏事故给人类带来的灾难,有同学提出如下看法:“科学技术给人类进步带来了贡献,也带来了灾难,可见,科学技术对人类发展并没有太大意义。”你是否同意此看法,请谈谈你的观点。
23.(6分)试依据核电荷数为1~18的元素的原子结构示意图,回答下列问题:
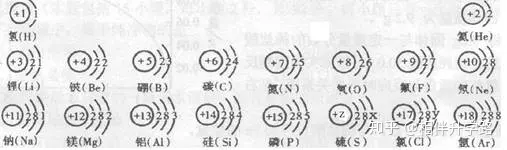
(1)上图中硫元素的核电荷数z=_______;氯元素的最外层电子数y=______(填数值),则与氯元素化 学性质相似的元素是______。
(2)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______,它的核外电子排布与_______元素的原子核外电子排布相同。
(3)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加。你还能找到哪些规律?试写出其中一个:
_________________________________________
24.(5分)下图是1~18号元素原子最外层电子数与原子核电荷数的关系图。
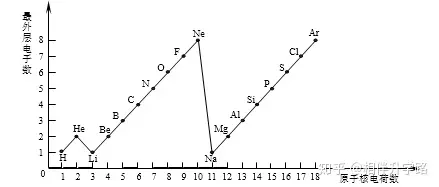
试回答:
(1)一个水分子共有____个原子核、____个质子。
(2)一个Mg2+核外共有____个电子,Cl—的最外层电子数和____原子的最外层电子数相同。
(3)通过上图你能发现哪些规律?请写出其中一个:
__________________________________ 。
25.(8分)右下图是从空气中分离氧气的示意图:请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条:
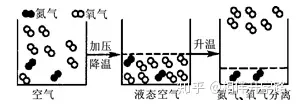
组成:_____________。
结构:_____________。
性质:_____________。
变化:_____________。

欢迎使用手机、平板等移动设备访问中考网,2024中考一路陪伴同行!>>点击查看