来源:网络资源 2023-03-23 19:40:55
金属与盐溶液反应的顺序问题
金属Fe和Zn同时放入CuSO4溶液中.
Zn先与CuSO4反应,等Zn反应完后,Fe才能与CuSO4发生反应.
金属Fe放入AgNO3和Cu(NO3)2的混合溶液中.
Fe先与AgNO3反应置换出Ag,等AgNO3反应完后,Fe才能和Cu(NO3)2反应置换出Cu.
小结:在金属活动性顺序表中,距离越远越先反应.
1.某金属(用R表示)能与盐酸发生置换反应,其金属活动性弱于Zn,相对原子质量小65,向一定质量的AgNO3、Cu(NO3)2和R(NO3)3混合溶液中加入Zn,充分反应后过滤,得到固体和溶液。向所得到的固体上滴加盐酸时有气泡产生。
(1)写出R与盐酸反应的化学方程式。
(2)所得到的固体中一定含有哪些金属?
(3)所得到的溶液的质量与原混合溶液的质量相比,可能增大,其原因是什么?
【答案】:
(1)2R+6HCl = 2RCl3+3H2↑
(2)Ag、Cu、R
(3)锌与硝酸银溶液反应,溶液质量减小;锌与硝酸铜、R(NO3)3溶液反应,溶液质量均增大.当增大的质量大于减小的质量时,溶液质量增大.
2.将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是【 】
A.滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2
B.滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2和Cu(NO3)2
C.滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3
D.滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO3
【点拨】:
向滤渣中加入稀盐酸无气泡说明滤渣中没有铁,首先置换出银,所以滤渣中一定有银,由于不知道铁的量,铜、硝酸铜无法确定.
反应后滤液和滤渣的成分分析
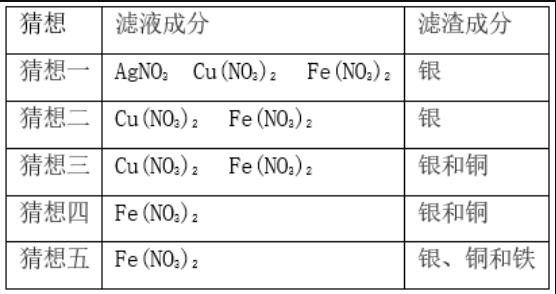
将一定量的铁粉加入到硝酸银和硝酸铜的混合溶液中,充分反应后过滤,滤液、滤渣的成分.
【小结】:
滤液中一定存在活动性最强的金属离子,滤渣中一定存在活动性最弱的金属单质.
若向滤渣中滴加稀盐酸有气泡产生
(1)滤渣中一定含有银、铜和铁
(2)滤液中一定含有Fe(NO3)2,一定不含有AgNO3 Cu(NO3)2
若向滤渣中滴加稀盐酸无气泡产生
(1)滤渣中一定含有银,一定不含有铁,可能含有铜
(2)滤液中一定含有Fe(NO3)2,可能含有AgNO3 Cu(NO3)2
若向滤液中滴加稀盐酸,有白色沉淀生成
(1)滤渣中一定含有银,一定不含有铜和铁
(2)滤液中一定含有AgNO3 Cu(NO3)2 Fe(NO3)2
若向滤液中滴加稀盐酸,无现象
(1)滤渣中一定含有银,可能含有铜和铁
(2)滤液中一定含有Fe(NO3)2,一定不含有AgNO3,可能含有Cu(NO3)2
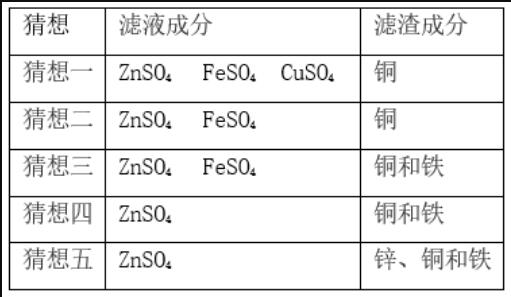
将一定量的铁粉和锌粉的混合物中加入硫酸铜溶液,充分反应后过滤,滤液、滤渣的成分.
其它化学反应的顺序问题
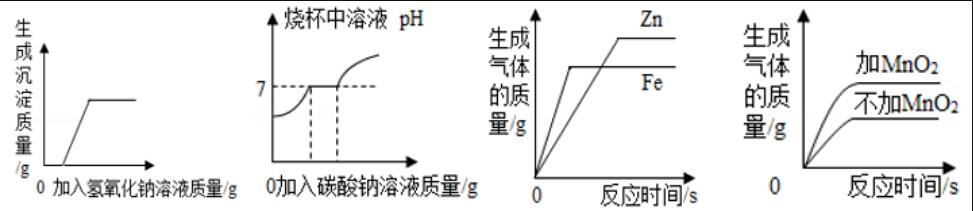
1.下列图象能正确反映其对应的实验操作的是【 】
A.向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液
B.向盛有一定量的氯化钙与盐酸混合溶液的烧杯中逐滴加入碳酸钠溶液至过量
C.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
向CuSO4和H2SO4的混合溶液中滴入NaOH溶液.
【点拨】:
H+优先与OH-反应(或OH-优先与H+反应).
当OH-发生的反应不止一个,出现反应顺序问题,OH-优先与H+反应
向CaCl2和HCl的混合溶液中滴入Na2CO3溶液.
【点拨】:
CO32-优先与H+反应
当CO32-发生的反应不止一个,出现反应顺序问题,CO32-优先与H+反应
【小结】:
溶液中有酸时,不可能在里面产生能溶于酸的沉淀(CaCO3、Cu(OH)2等).
反应生成的沉淀或气体能继续发生反应,则生成沉淀或气体的反应后发生.
有关金属的活动性顺序探究的题
1.现有甲、乙、丙三种金属,甲在常温下就能与氧气反应,乙、丙在常温下几乎不与氧气反应:如果将乙、丙分别放入硫酸铜溶液中,过一会儿,在丙的表面有红色固体析出,而乙表面没有变化,则甲、乙、丙三种金属的活动性由弱到强的顺序是 【 】
A.甲 乙 丙 B.乙 甲 丙
C.乙 丙 甲 D.甲 丙 乙
2.有甲、乙、丙三种金属,如果将甲、乙、丙分别放入硫酸铜溶液中,一段时间后,乙、丙表面出现红色物质,甲没有明显现象;再将大小相同的乙、丙分别放入相同溶质质量分数的稀盐酸中,乙、丙均产生气泡,但丙产生气泡的速度明显快于乙,则甲、乙、丙三种金属的活动性顺序是【 】
A.丙>乙>甲 B.甲>丙>乙
C.丙>甲>乙 D.甲>乙>丙
3.为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是_____ (填序号)。
① 将铝、银分别浸入到硫酸铜溶液中
② 将银 分别浸入到硫酸铝、硫酸铜溶液中
③ 铜、银分别浸入到硫酸铝溶液中
④将铜分别浸入到硫酸铝、硝酸银溶液中
【点拨】: 两边的金属和中间的盐溶液 ,中间的金属和两边的盐溶液
4.为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:
①铝片浸入稀硫酸中
②铜片浸入稀硫酸中
③铝片浸入硫酸亚铁溶液中。
这组实验还不能完全证明三种金属的活动性顺序,请补充一个实验来达到目的(写出实验步骤、现象和化学方程式).
【答案】:
将铁片浸入硫酸铜溶液中,铁片表面有红色固体析出。(或将铁片浸入稀硫酸中,有气泡产生等。)
Fe+CuSO4=FeSO4+Cu
(或Fe+H2SO4=FeSO4+H2↑等)
5.某研究性学习小组设计下列实验方案,验证铁、铜、银三种金属的活动性顺序,每种方案所需试剂如下(反应所得产物可用作试剂进一步反应),其中不可行的方案是【】
A.铜、硝酸银溶液、氯化亚铁溶液
B.银、铜、氯化亚铁溶液
C.铁、银、氯化铜溶液
D.铁、硝酸银溶液、氯化铜溶液
【点拨】:D.生成的铜当反应物用了
【小结】:
1. 金属与氧气或酸反应越剧烈,说明金属活动性越强.
2. 金属与盐溶液能发生反应,说明金属的活动性比盐中金属的活动性强.
3. 以化合态存在的金属比以单质形式存在的金属活动性强.
欢迎使用手机、平板等移动设备访问中考网,2025中考一路陪伴同行!>>点击查看
C闂佹彃绉寸花锟�闁瑰瓨鍔欓崗锟�闂傗偓閹稿海鐓�闂傗偓閹稿孩袣