来源:网络资源 2023-08-12 21:35:57
一、溶液的形成
1
溶液
(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液
(2)溶液的基本特征:均一性、稳定性的混合物
注意:
a、溶液不一定无色,如CuSO4为蓝色FeSO4为浅绿色Fe2(SO4)3为黄色
b、溶质可以是固体、液体或气体;水是最常用的溶剂
c、溶液的质量=溶质的质量+溶剂的质量
溶液的体积≠ 溶质的体积 +溶剂的体积
d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)
2
溶质和溶剂的判断
固体、气体溶于液体,液体为溶剂
液体溶于液体,有水,水为溶剂,无水,量多的为溶剂
3
饱和溶液、不饱和溶液
(1)概念:
(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解
(3)饱和溶液和不饱和溶液之间的转化
注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低
②最可靠的方法是:加溶质、蒸发溶剂
(4)浓、稀溶液与饱和不饱和溶液之间的关系
①饱和溶液不一定是浓溶液
②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液
③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓
(5)溶解时放热、吸热现象
溶解吸热:如NH4NO3溶解
溶解放热:如NaOH溶解、浓H2SO4溶解
溶解没有明显热现象:如NaCl
二、溶解度
1
固体的溶解度
(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g含义:
在20℃时,在100克水中最多能溶解36克NaCl
或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克
(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度
大多数固体物的溶解度随温度升高而升高;
如KNO3 少数固体物质的溶解度受温度的影响很小;
如NaCl极少数物质溶解度随温度升高而降低。如Ca(OH)2
(4)溶解度曲线
例:(1)t3℃时A的溶解度为80g
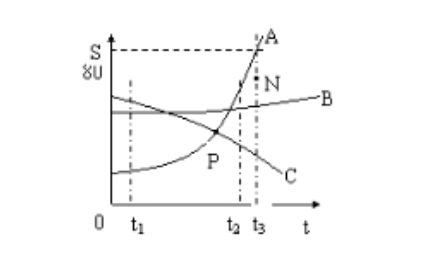
(2)P点的含义在该温度时,A和C的溶解度相同
(3)N点为t3℃时A的不饱和溶液,可通过 加入A物质,降温,蒸发溶剂的方法使它变为饱和
(4)t1℃时A、B、C、溶解度由大到小的顺序C>B>A
(5)从A溶液中获取A晶体可用降温结晶的方法获取晶体。
(6)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体。
(7)t2℃时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B无晶体析出的有C,所得溶液中溶质的质量分数由小到大依次为A
(8)除去A中的泥沙用过滤 法;分离A与B(含量少)的混合物,用结晶法
2
气体的溶解度
(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素:①气体的性质②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大)
3
混合物的分离
(1)过滤法:分离可溶物+难溶物
(2)结晶法:分离几种可溶性物质
结晶的两种方法蒸发溶剂,如NaCl(海水晒盐)降低温度(冷却热的饱和溶液,如KNO3)
三、溶质质量分数
1
溶质的质量分数
溶液中溶质的质量分数是溶质质量与溶液质量之比。
溶液中溶质的质量分数可以用下式计算:
溶质质量分数= ×100%
×100%
应该注意:
①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
2
饱和溶液、不饱和溶液
与溶质的质量分数的关系
①浓溶液中溶质的质量分数大,但不一定是饱和溶液,稀溶液中溶质的质量分数小,但不一定是不饱和溶液。
②对溶质与溶剂均相同的溶液来说,在相同状况(同温、同压)下,饱和溶液总比不饱和溶液要浓,即溶质的质量分数要大
3
溶质的质量分数
与溶解度的区别与联系
溶解度是用来表示一定温度下,某物质在某溶剂中溶解性的大小。溶质的质量分数用来表示溶液组成。
4
配制一定质量、
溶质质量分数一定的溶液
实验目的:
①练习配制50g溶质质量分数为5%的蔗糖溶液。
②加深对溶质质量分数概念的理解。
实验用品:
托盘天平、烧杯、玻璃棒、药匙、量筒(10mL、100mL)、蔗糖。
实验步骤:
①计算
根据溶质质量分数的公式,计算配制50g溶质质量分数为5%的蔗糖溶液所需要的:Ⅰ蔗糖质量:50g×5%=2.5g,Ⅱ水的质量:50g-2.5g=47.5g
②称量(量取)
用托盘天平称量2.5g蔗糖倒入烧杯中,把水的密度近似地看作1g/cm3,用量筒量取47.5mL水。
(思考:为什么不选用10mL的量筒呢?如果选用10mL的量筒,需要量取5次才能量取到所需的水,这样将会导致误差偏大。)
③溶解
把量好的水倒入盛有蔗糖的烧杯中,用玻琉棒搅拌,加速蔗糖的溶解。
④贮存
把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,放到试剂柜中。
5
关于溶液稀释或增浓的计算
①关于溶液稀释的计算
因为溶液稀释前后,溶质的质量不变;
所以若设浓溶液质量为Ag,溶质的质量分数为a%,加水稀释成溶质的质量分数为b%的稀溶液Bg,则Ag×a%=Bg×b%(其中B=A+m水)
②关于溶液增浓(无溶质析出)的计算
溶液增浓通常有几种情况:
a、向原溶液中添加溶质:
因为溶液增加溶质前后,溶剂的质量不变。
增加溶质后,溶液中溶质的质量=原溶液中溶质的质量+增加的溶质的质量,而溶液的质量=原溶液的质量+增加的溶质的质量。
所以,若设原溶液质量为Ag,溶质的质量分数为a%,加溶质Bg后变成溶质的质量分数为b%的溶液,则Ag×a%+Bg=(Ag+Bg)×b%。
b、将原溶液蒸发去部分溶剂
因为溶液蒸发溶剂前后,溶质的质量不变。
所以,若设原溶液质量为Ag,溶质的质量分数为a%,蒸发Bg水后变成溶质的质量分数为b%的溶液,则:Ag×a%=(Ag-Bg)×b%。
c、与浓溶液混合
因为混合后的溶液的总质量等于两混合组分溶液的质量之和,混合后的溶液中溶质质量等于两混合组分的溶质质量之和。
所以,设原溶液质量为Ag,溶质的质量分数为a%,浓溶液质量为Bg,溶质的质量分数为b%,两溶液混合后得到溶质的质量分数为c%的溶液;
则:Ag×a%+Bg× b%=(Ag+Bg)×c%。
6
关于溶质质量分数
运用于化学方程式的计算
解这类问题时要注意:
①化学方程式下相对应的物质质量不能直接写溶液质量,而要写参加化学反应的溶质实际质量。
②若已知溶液的体积或求溶液的体积,要用m=ρV这个公式进行换算。
③单位要统一。
7
关于溶液中溶质的
质量分数计算的具体情况
①若溶质全部溶于水,且不与水发生化学反应,直接利用上述计算公式进行计算。
②若溶质虽不与水反应,但没有全部溶解,则溶质质量只计算溶解部分,未溶解部分不能参与计算。
③若溶质溶于水时与水发生了化学反应,则溶液中的溶质就为反应后的生成物了。
④若溶质为结晶水合物,溶于水后,其溶质的质量就不包括结晶水的质量。因为结晶水合物溶于水时,结晶水就转化为溶液中的溶剂了。
⑤关于酸、碱、盐溶液间发生1~2个化学反应,求反应后所得溶液——溶质质量分数问题的计算。
首先要明确生成的溶液中溶质是什么,其次再通过化学反应计算溶质质量是多少,(往往溶质质量由几个部分组成)
最后分析各量间关系求出溶液总质量,再运用公式计算出反应后溶液中溶质的质量分数。
⑥给定溶液中某种元素的质量分数或溶液中某种离子与水分子的个数比等形式,计算溶质的质量分数。
如某NaCl溶液中,Na+︰H2O(数目)=1︰100,计算NaCl的质量分数。
编辑推荐:

欢迎使用手机、平板等移动设备访问中考网,2023中考一路陪伴同行!>>点击查看